Práctica N° 1: Identificación preliminar de cationes con ensayos a la llama.
Objetivo:
- Reconocer la presencia de determinados metales por el color que aparece al exponer sus compuestos a la llama de un mechero.
- Conocer de donde proceden los distintos colores de los fuegos artificiales.
- Producir fuegos de distintos colores.
- Explicar los espectros a los alumnos de Bachillerato.
Importante:
- Antes de la realización de la práctica ( en todas ) es necesario tomar, entender y asimilar las instrucciones de seguridad, puesto que son necesarios para mantenerte en plena salud.
- Usar gafas, guantes de latex, bata de laboratorio, cubre bocas, zapato cerrado y es recomendable (en caso del sexo femenino) recogerse el cabello. Ya que a veces se trabajan con compuestos altamente tóxicos y corrosivos que pueden atentar de diferentes formas contra la salud inclusive si llegasen a ser ingeridos conducir a una posible muerte.
- Leer las fichas técnicas de los compuestos a utilizar previo al desarrollo de la práctica, ésto nos ayudará a familiarizarnos con el reactivo a tratar.
- Antes de comenzar la práctica, lavar todos los materiales a utilizar, enjuagar con agua destilada y dejar secar a temperatura ambiente. Es importante porque nunca sabes los residuos que contengan los materiales y si vayan traer consecuencias perjudiciales a la hora de hacer el análisis. Este paso también se realiza al finalizar.
Desarrollo de la práctica:
- Para la elaboración de nuestro reactivo: Al vaso de precipitado se le adhieren 25 ml. de agua destilada, se agrega la sal, se agita para tener una solución uniforme, posteriormente se añaden 25 ml de alcohol y nuevamente se agita.
- Se traslada a nuestro atomizador ( ya etiquetado con el nombre del compuesto que tendrá) se cella perfectamente para evitar escapes de vapores.
- Es disparado a la llama y observado.
- Se realiza este proceso con todas las sales.
 Haciendo el reactivo( 25 ml de agua destilada, 25 ml de alcohol y la sal)
Haciendo el reactivo( 25 ml de agua destilada, 25 ml de alcohol y la sal) Observaciones:
En el tiempo en que se observó la llama al dispararle las soluciones nos podemos percatar de que presenta diferentes coloraciones características de cada metal (se deben a que han pasado a estados energéticos excitados debido a que absorben energía de la llama). Esto ocurre porque los átomos metálicos en forma de de iones positivos en el estado solido cuando se calientan se disocian dando átomos gaseosos y no iones. Los compuestos confieren a la llama los mismos colores característicos que los elementos.
Cuestionario:
1._¿ Qué diferencia encuentras entre una identificación preliminar y una confirmativa?
La preliminar es aquella que no es definitiva, pueden ayudar a aclarar el panorama antes de obtener información definitiva y concluyente, es decir los datos que arroje el análisis son susceptibles a la información, por otra parte la identificación confirmatoria se realiza un proceso que respalde, valide y compruebe los datos obtenidos en la identificación preliminar ( deja de ser una hipótesis y seria una teoria)
2._Define con tus propias palabras el término "enmascaramiento"
El enmascaramiento interviene con algo que quiere analizarse, puesto que oculta y/o esconde ello para que no se pueda apreciar con originalidad como realmente es.
3._¿Qué entiendes por "espectro de emisión"?
El espectro de emisión de cada elemento es único y puede ser usado para determinar si ese elemento es parte de un compuesto desconocido las características del espectro de emisión de algunos elementos son claramente visibles a ojo descubierto cuando con calentados.
4._Elabora un esquema de la flama que proporciona el mechero Bunsen, indicando las zonas de oxidación y reducción. Indica También las temperaturas a las que se alcanzan ambas.
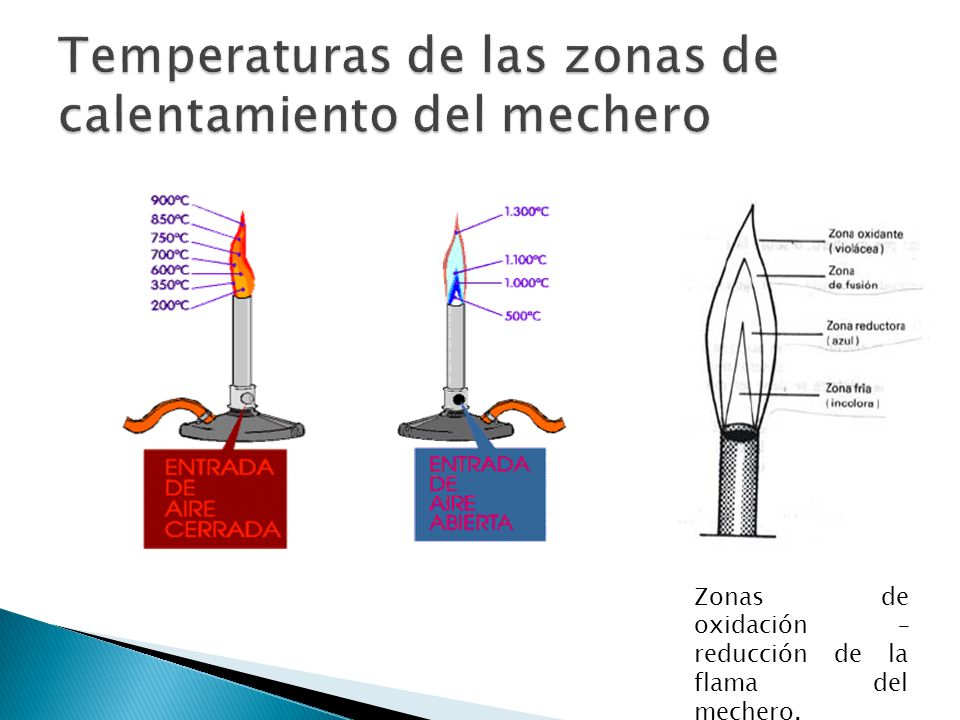
Humedecer la sal, para esta al pasar por la llama presente la coloración correspondiente al cation presente. Se necesitan cloruros para volatilizar.
6._Investiga las sales que se emplean para proveer los diversas coloraciones en pirotecnia.
7._ Elabora esquemas coloreados de cada uno de los iones identificados.

Bibliografía:
Vídeo filmado durante la práctica
Fecha: 21/Septiembre/2015
Práctica N° 2: Ensayo a la perla de Bórax
Objetivo:
Emplear el ensayo a la perla de Bórax como un medio para identificar cationes por la coloración de la perla formada.
Fundamento:
Estos ensayos se basan en el hecho de que el tetraborato sódico decahidratado, Na2B40710H20 (Bórax) en el estado fundido reacciona con los compuestos de diferentes metales formando sustancias vidriosas del color característico.
Importante:
Utiliza el equipamiento de laboratorio completo para desarrollar esta práctica ya que se trabajará con reactivos altamente corrosivos, tóxicos y además de ellos dañinos para para la salud por vías respiratorias ( para más información consultar las fichas técnicas de los compuestos a tratar). Sigue las instrucciones de seguridad.
Desarrollo de la práctica:
-Lavar todo el material a utilizar.
- Se somete el asa de platino a HCL, se agrega Bórax, después lo colocamos a la llama ( para la formación de la perla), ya que esta formada la perla se le agrega un poco de sal y finalmente se observa la coloración que presenta la llama.
- Para deshacer la perla se calienta a la llama y posteriormente es sumergida a agua destilada. Se repite este proceso con todas las sales.
Resultados:
Aquí se pueden apreciar las sales que vamos a utilizar para el análisis, colocadas en distintas cucharas y etiquetadas.
Podemos percatarnos de que se está agregando la sal a la perla de Bórax para su posterior análisis
 Mechero de Bunsen
Mechero de Bunsen Aquí la perla ya está hecha y vamos a exponerla al calor de la llama del mechero de Bunsen
Aquí la perla ya está hecha y vamos a exponerla al calor de la llama del mechero de BunsenExplicación:
Los compuestos de los metales contenidos en la muestra, se transforman por calentamiento de óxidos, que después reaccionan con el anhídrido bórico formando metaboros.
El color diferente de la perla en la llama oxidante y reductora se debe a la formación de metaboros correspondientes a diferentes estados de oxidación del metal.
Cuestionario:
1._ Elabora un concentrado con los colores observados en la perla con cada cation en las zonas reductoras y oxidantes.
2._ Escribe las reacciones de la formación de óxidos y metaboros para cada catión
BaB202
Mn3(BO3)2
Sr3(BO3)2
KBO2
Cr3(BO3)2
Ca3(BO3)2
3._ Investiga la ficha técnica del tetraborato de sodio decahidratado
4._ Elabora y dibuja una flama del mechero de Bunsen, indicando la zona reductora y la zona oxidante con dos colores diferentes.
5._¿Cómo se realizan los ensayos sobre el Carbón?
Se emplea para estos ensayos la llama luminosa de Bunsen( la entrada completamente cerrada). En la cavidad de un trozo de carbón se coloca la muestra pura o mezclada con algún fundente (Carbón , Na2CO3) y se somete a la acción del dardo de un soplete que puede ser oxidante y/o reductora. Se produce una llama reductora colocando en el pico del soplete un poco fuera de la llama del mechero se sopla con suavidad para que el cono sea el que actúe sobre la sustancia
.
Se puede observar los siguientes fenómenos:
- Deflagración.- Debido al desprendimiento de oxigeno con facilidad, se produce por la presencia del nitrato, clorato, bromato. perclorato, etc
- Decrepitación.- Por rotuta violenta de cristales que contiene agua de interposición como por ejemplo NaCl, Galena(PbS), baritina.
- Metales que producen botón: Cu: rojo soluble en HNO3; Ag blanco soluble en HNO3; Sn: blanco soluble en HCl(10 N); Au: amarillo soluble en agua regia.
- Metales que producen aureolas y boton:Sb: botón quebradizo gris y aureola blanca a azul; Bi: botón quebradizo gris; aureola amarilla anaranjado; Pb: boton maleable gris, tizna el papel y aureola amarilla
- Metales que producen aureola de oxido: As : blanca muy volátil Zn: amarilla en caliente, blanca en frió; Cd pardo rojiza.
- Metales que se reducen pero no funden fácilmente, quedan a manera de pajitas o polvo: Pt, Fe, Ni, Co, Pd, Ir, Os.
Bibliografía
Vídeo filmado durante la práctica
Fecha: 23/ Septiembre/ 2015








No hay comentarios.:
Publicar un comentario